La diferencia entre elementos y compuestos es parte de una comprensión muy importante en el estudio de la química. Además, estos son sustancias puras que existen en la naturaleza. Lo más notable es que la principal diferencia entre elemento y compuesto es que el primero se compone de los mismos tipos de átomos, mientras que el último se compone de diferentes elementos. Siga leyendo para obtener más información!

Elemento |
Compuesto |
|
| Definición | Una sustancia que contiene átomos del mismo tipo. | Una sustancia que tiene átomos que pertenecen a una combinación de diferentes elementos. |
| Composición | Tiene un solo tipo de átomo, y cada átomo tiene su propio número atómico. | Tienen diferentes elementos cuya disposición está en una proporción definida a través de enlaces químicos. |
| Representación | La representación de un elemento se realiza mediante el uso de un símbolo. | La representación de un compuesto es mediante el uso de una fórmula química. |
| Posibilidad de averiarse | No es posible descomponer los elementos en sustancias más simples mediante el uso de reacciones químicas. | La descomposición o separación de compuestos en sustancias más simples mediante el uso de reacciones químicas es ciertamente posible |
| Ejemplos | Oxígeno (O), Hidrógeno (H), Cloro (Cl), Sodio (Na), etc. | Cloruro de sodio (NaCl), agua (H2O), etc. |
| Tipos | Hasta el momento se han observado 117 elementos. | La creación de un número virtualmente ilimitado de compuestos ciertamente puede tener lugar |
| Clasificación | Su clasificación puede ser metaloide, metálica y no metálica. | Su clasificación puede ser como compuestos iónicos, compuestos moleculares, complejos y compuestos intermetálicos. |
Definición de elemento
Un elemento se refiere a una sustancia que comprende solo un tipo de átomo. Un buen ejemplo de ello es el del átomo de hidrógeno, ya que sus átomos tienen un solo protón y un solo electrón. Además, si se produce un cambio en el número de protones de un átomo, cambia el tipo de elemento.

Definición de compuesto
Un compuesto se refiere a una sustancia que se forma debido a una combinación de dos o más elementos que son diferentes entre sí. Esta combinación de elementos se produce de tal manera que los átomos pertenecientes a diferentes elementos están unidos por enlaces químicos. Estos enlaces se forman debido al intercambio de electrones entre los átomos.
Diferencias en propiedades
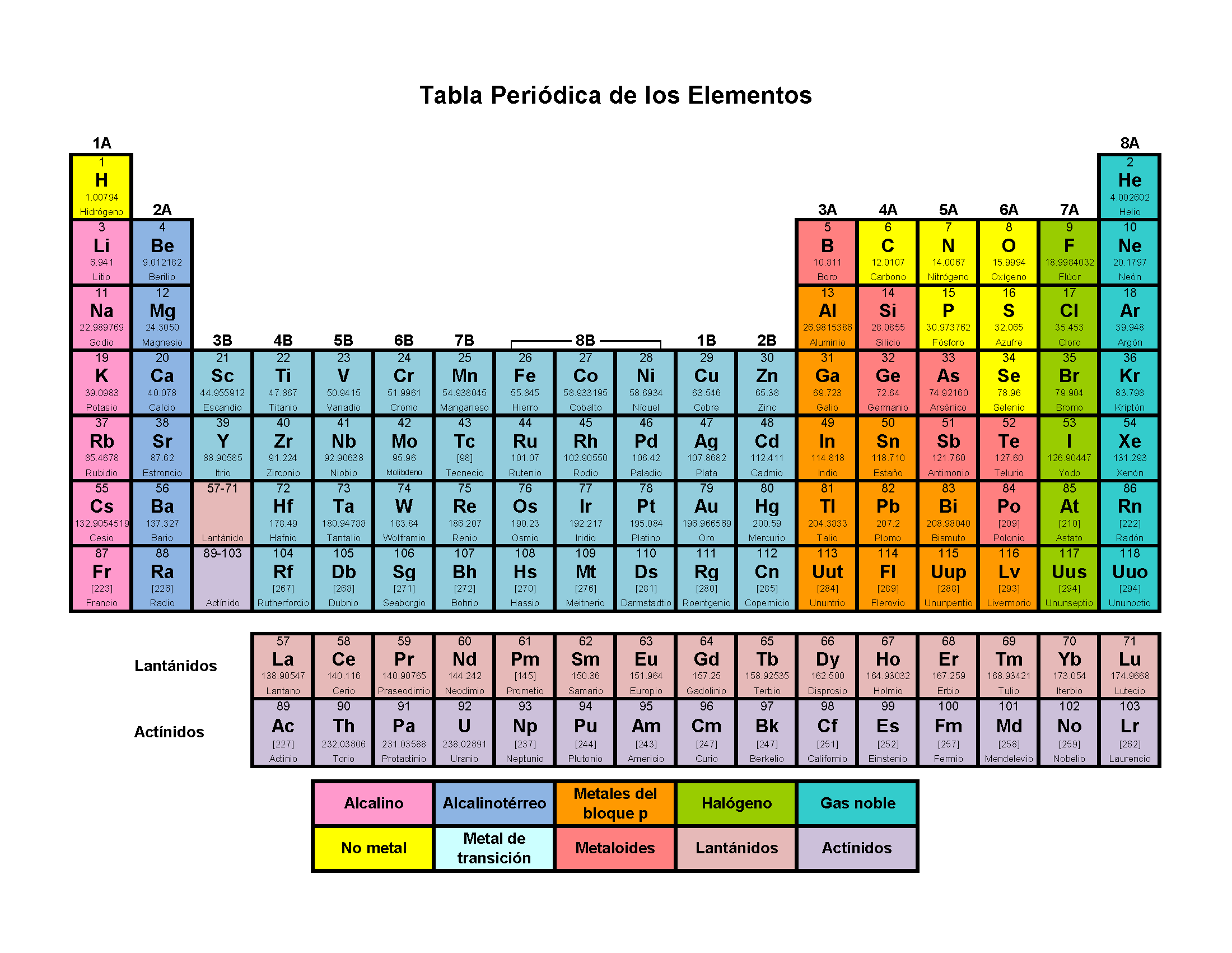
Los elementos se distinguen por su nombre, símbolo, número atómico, punto de fusión, punto de ebullición, densidad y energías de ionización. En la Tabla Periódica, los elementos están ordenados según su número atómico y agrupados según propiedades químicas similares y están representados por sus símbolos.
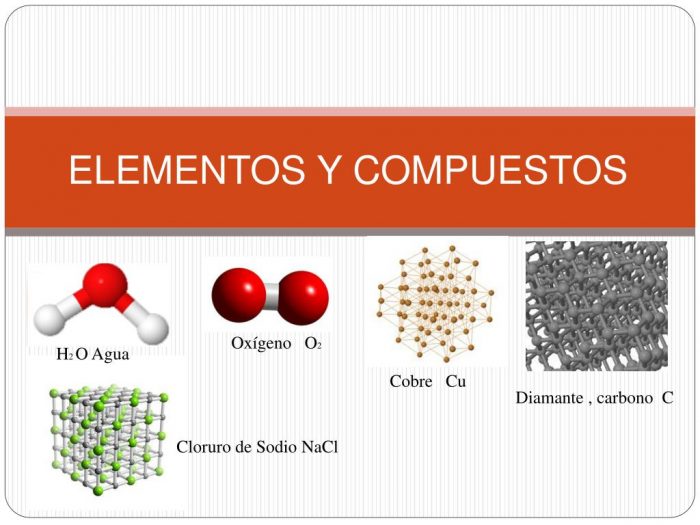
- Número atómico: el número atómico se indica con la letra Z y es el número de protones presentes en el núcleo del átomo del elemento. Por ejemplo el carbono tiene 6 protones en su núcleo, por lo tanto, Z = 6. El número de protones también es indicativo de la carga eléctrica o el número de electrones presentes en el núcleo, lo que determina las propiedades químicas del elemento.
- Masa atómica: la letra A indica la masa atómica del elemento, que es el número total de protones y neutrones en el núcleo de un átomo del elemento. Los isótopos de los mismos elementos difieren en sus masas atómicas.
- Isótopos: los isótopos de un elemento tienen el mismo número de protones en su núcleo pero difieren en el número de neutrones. Los elementos de origen natural tienen más de un isótopo estable. Por tanto, los isótopos tienen propiedades químicas similares (debido al mismo número de protones) pero diferentes propiedades nucleares (debido al diferente número de neutrones). Por ejemplo el carbono tiene tres isótopos, carbono 12, carbono 13 y carbono 14.
- Alótropos: los átomos de un elemento pueden formar enlaces entre sí de más de una forma, lo que genera diferencias en sus propiedades químicas. Por ejemplo el carbono se une en un tetraedro para formar un diamante y las capas de hexágonos de carbono forman grafito.
Los compuestos están compuestos por diferentes elementos en una proporción fija. Por ejemplo, 1 átomo de sodio (Na) se combina con 1 átomo de cloro (Cl) para formar una molécula de compuesto de cloruro de sodio (NaCl). Los elementos de un compuesto no siempre conservan sus propiedades originales y no se pueden separar por medios físicos. La combinación de elementos se ve facilitada por su valencia. La valencia se define como el número de átomos de hidrógeno necesarios que pueden combinarse con un átomo del elemento que forma el compuesto.
La mayoría de los compuestos pueden existir como sólidos (temperaturas suficientemente bajas) y pueden descomponerse mediante la aplicación de calor. A veces, los elementos extraños quedan atrapados dentro de la estructura cristalina de los compuestos, lo que les da una estructura no homogénea. Los compuestos se representan por su fórmula química que sigue el sistema de Hill, en el que los átomos de carbono se enumeran primero, seguidos de los átomos de hidrógeno, después de los cuales los elementos se enumeran en orden alfabético.
Visualizando las diferencias
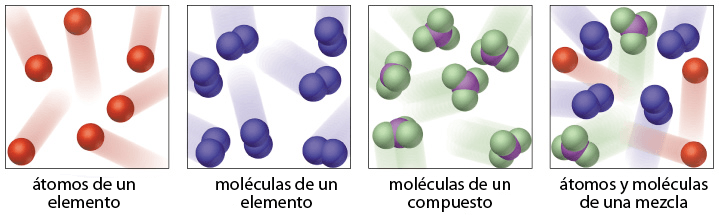
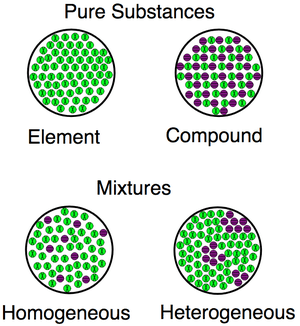
Esta imagen muestra las diferencias entre elementos y compuestos a nivel atómico. Los elementos tienen solo 1 tipo de átomos; los compuestos tienen más de 1. Los elementos y los compuestos son sustancias; se diferencian de las mezclas en las que se mezclan diferentes sustancias, pero no mediante enlaces atómicos.
Historia de los elementos y compuestos
Los elementos se utilizaron inicialmente como una referencia a cualquier estado de la materia como líquido, gas, aire, sólido, etc. Las tradiciones india, japonesa y griega se refieren a cinco elementos: aire, agua, tierra, fuego y éter. Aristóteles conceptualizó un nuevo quinto elemento llamado ‘quintaesencia‘, que aparentemente formó los cielos. A medida que continuaba la investigación, muchos científicos eminentes allanaron el camino para la comprensión y descripción actual de los elementos. Entre ellos, destacan los trabajos de Robert Boyle, Antoine Lavoisier, Dmitri Mendeleev. Lavoisier fue el primero en hacer una lista de elementos químicos y Mendeleev fue el primero en ordenarlos según su número atómico en la Tabla Periódica. La definición más actual de elemento la otorgan los estudios realizados por Henry Moseley que afirman que el número atómico de un átomo se expresa físicamente por su carga nuclear.
Antes del siglo XIX, el uso del término compuesto también podía significar una mezcla. Fue en el siglo XIX cuando se pudo distinguir el significado de un compuesto de una mezcla. Alquimistas como Joseph Louis Proust, Dalton y Berthollet y sus estudios sobre varios compuestos han dado a la química moderna la definición actual de compuesto. El trabajo de Proust demostró al mundo de la química que los compuestos eran composición constante de los elementos respectivos.
Número CAS
Cada sustancia química se identifica por su identificador numérico único: el número CAS (servicio de resúmenes químicos). Por lo tanto, cada elemento y compuesto químico tiene un número CAS. Esto hace que la búsqueda de elementos y compuestos en la base de datos sea más conveniente.
Más detalles sobre los elementos
Un elemento es una sustancia en la que los átomos tienen el mismo número de protones. En consecuencia, esto significa que los átomos de un elemento tienen el mismo número atómico. La descomposición de elementos no es posible y, por lo tanto, son las sustancias más simples.

A pesar de que todos los átomos de un elemento deben tener el mismo número de protones, su número de neutrones ciertamente puede ser diferente. En consecuencia, también pueden ser de diferentes masas. Además, los isótopos son formas de un elemento cuyos átomos tienen diferentes números de neutrones.
Ciertamente, existe una diferencia entre elementos y componentes. Este ultimo se refiere a una pequeña parte de una entidad más grande que en su mayoría es un objeto fabricado. Por el contrario, el primero es una de las partes más simples de las que consta todo.
Más detalles sobre los compuestos
Existe diferencias entre mezcla y compuesto, ya que la primera se produce con la realización de una mezcla física de varias sustancias. Por el contrario, la segunda se produce debido a una combinación de múltiples sustancias a través de una reacción química.

A menudo, un compuesto no se comporta como ninguno de los elementos que lo componen. Por ejemplo, los elementos hidrógeno (H) y oxígeno (O) tienden a ser gases a temperatura ambiente, cuando la presión atmosférica es normal. Sin embargo, el agua compuesta es líquida a temperatura ambiente, manteniendo la presión atmosférica normal.
Los átomos de algunos elementos no se unen fácilmente a otros elementos. Por tanto, no forman compuestos. Los más notables son los gases inertes o nobles como el neón, el argón, el helio, el xenón, el criptón y el radón.