Es sabido en el mundo de la química que una forma para clasificar los ácidos y bases depende de la fuerza de su ionización de las sustancias en un medio acuoso. Por lo tanto, un ácido y base será fuerte cuando se ioniza completamente, es decir, se transforman en cationes o iones positivos y en aniones o iones negativos. Por su parte, un ácido y base son débiles cuando en agua se ionizan parcialmente, dando lugar a una proporción de cationes, de aniones y también de moléculas no disociadas.
| Ácidos y bases fuertes | Ácidos y bases débiles | |
| Definición | Refiere a aquellas sustancias que en solución se ionizan totalmente. | Hace alusión a sustancias que en solución solo se ionizan de manera parcial. |
| Ionización | Es completa. | Es parcial. |
| Ejemplos |
Ácidos fuertes: ácido clorhídrico, ácido sulfúrico o el ácido perclórico, entre otros. Bases fuertes: hidróxido de sodio, hidróxido de litio o hidróxido de potasio, entre otros. |
Ácidos débiles: ácido acético, ácido nitroso o ácido fosfórico, entre otros. Bases débiles: etilamina, amoníaco, bencilamina, entre otros. |
Ácidos y bases fuertes

Un ácido o base son fuertes cuando en un medio acuoso se disocian completamente, ya que lo que se produce es una ionización total. Por lo tanto, en la solución se encontrará la misma concentraciones de aniones que de cationes. Aquí se ve claramente que el resultado no es dinámico como en el caso de los débiles ni mucho menos reversible.
Ejemplos de ácidos fuertes son el ácido clorhídrico, el ácido sulfúrico, el ácido nítrico, ácido crómico o el perclórico, entre otros. Ejemplos de bases fuertes pueden ser el hidróxido de sodio, de litio, de potasio, calcio, aluminio, entre otros.
Un buen ejemplo de la ionización fuerte nos lo da el ácido clorhídrico HCl, cuya fórmula la componemos a continuación.
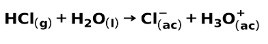
Ácidos y bases débiles

Un ácido o base se denomina débil cuando en una solución acuosa solo se ioniza de manera parcial, esto da lugar a un dinámico equilibrio, reversible, ya que en se van a presentar iones pero también moléculas no ionizadas. Dicho de otra manera, no se disocian completamente en una solución.
Con lo anteriormente mencionado, se puede decir una regla: la fuerza del ácido o base débil dependerá de cuánto se disocien y mientras mayor sea esta disociación también mayor será su fuerza. Aquí es cuando aparece en fórmula la constante de disociación Ka , la cual representa la constante de equilibrio para la reacción de disociación de un ácido.
A continuación presentamos la fórmula de cómo se ioniza un ácido o base débil (ácido acético CH3COOH), además de la otra fórmula que expresa la constante del equilibrio en el mismo proceso.
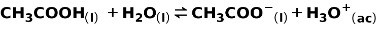
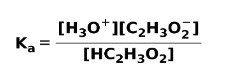
Ejemplos de ácidos débiles son el ácido acético, el hipocloroso, nitroso, láctico, carbónico, entre otros. Ejemplos de bases débiles pueden ser el amoníaco, la anilina, la etilamina, entre otros.