La reacción química en la que la energía se absorbe en forma de calor se conoce como reacción endotérmica, mientras que tales reacciones químicas en las que la energía se libera o evoluciona en forma de calor se conocen como reacción exotérmica. Entonces, la principal diferencia entre estos términos radica en la forma de energía utilizada o liberada durante cualquier reacción química. Siga leyendo para obtener más información.
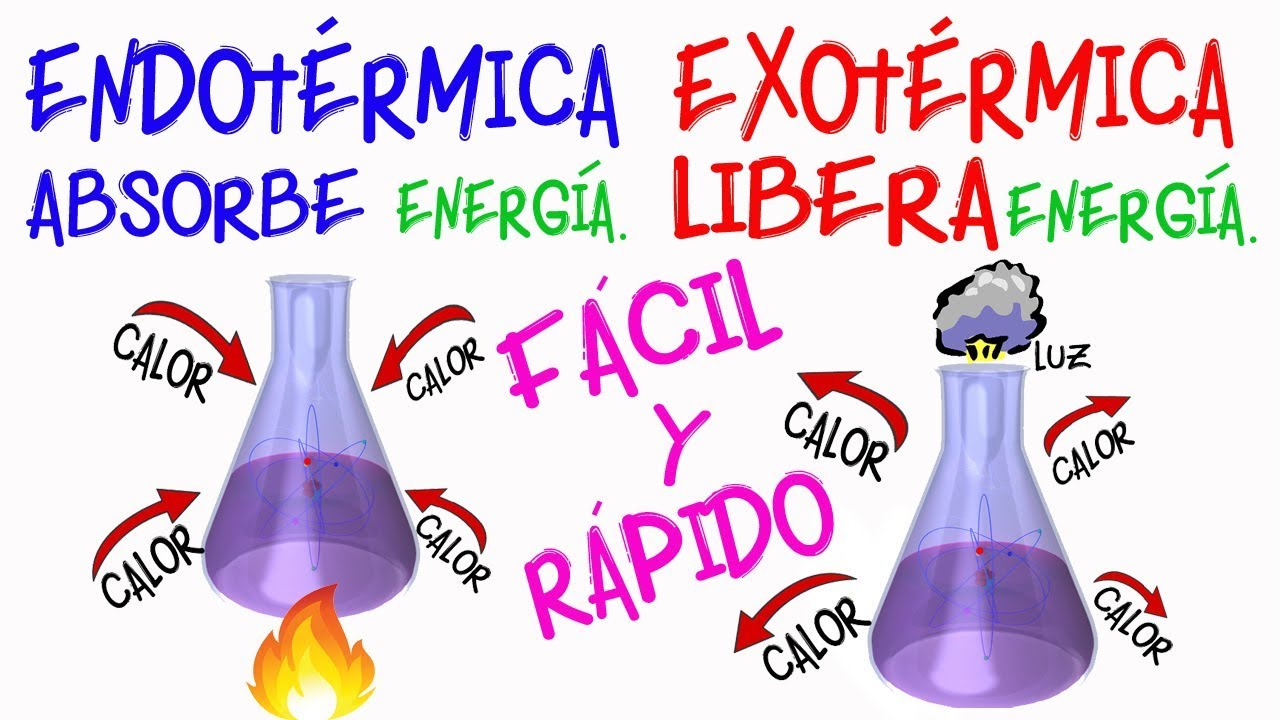
Reacción endotérmica |
Reacción exotérmica |
|
| Definición | Las reacciones químicas que implican el uso de energía en el momento de la disociación para formar un nuevo enlace químico se conocen como reacción endotérmica. | Las reacciones químicas donde la energía se libera o evoluciona en forma de calor se conoce como reacción exotérmica. |
| Energía | El proceso endotérmico requiere energía en forma de calor. | El proceso exotérmico evoluciona o se libera en forma de calor. |
| Entalpía (ΔH) | ΔH es positivo, ya que el calor se absorbe. | ΔH es negativo, ya que el calor evoluciona. |
| Ejemplos | 1. Conversión de hielo en vapor de agua por ebullición, fusión o evaporación. 2. Rotura de las moléculas de gas. 3. Producción de sal anhidra a partir de hidrato. |
1. Formación de hielo a partir del agua. 2. Quema de carbón (combustión). 3. La reacción entre el agua y el ácido fuerte. |
Definición de reacción endotérmica
Como su nombre indica, «endo» significa «absorber» mientras que «térmico» se refiere a «calor». Por lo tanto, podemos definir las reacciones endotérmicas como una reacción química en la que la energía se absorbe durante la conversión del reactivo en el producto. Esto sucede debido a la disociación de los enlaces entre las moléculas. Más tarde, la energía se libera, cuando se forman los nuevos enlaces.
En la reacción endotérmica, los productos contienen más energía que los reactivos. En estas reacciones, el calor se absorbe de los alrededores, debido a lo cual la temperatura del sistema donde va la reacción se mantiene más fresca. Incluso la entalpía (ΔH), que se define como el cambio en la energía térmica durante la conversión de los reactivos a los productos, aumenta al final de la reacción.
El valor de ΔH o DH o DE siempre es positivo.

Pocos ejemplos comunes de reacciones endotérmicas son:
- 1. Fotosíntesis: el proceso en el que la clorofila presente en las plantas verdes convierte el agua y el dióxido de carbono en glucosa y oxígeno, en presencia de la luz solar, que funciona como proveedor de energía.
- 2. Cuando se toma la pequeña cantidad de cloruro de amonio (NH4Cl) en un tubo de ensayo y se disuelve en agua, observamos que el tubo de ensayo se enfría. En esta reacción, el calor se absorbe de su entorno (tubo de ensayo).
- 3. Conversión de hielo en agua por ebullición, fusión o evaporación.
Definición de reacción exotérmica
Aquí «exo» se refiere a «liberar o evolucionar», y «térmico» se refiere a «calor». Por lo tanto, la reacción exotérmica se puede definir como una reacción química en la que la energía se libera o evoluciona. Este tipo de reacciones son más cálidas y, a veces, son peligrosas si la reacción es más alta.
En una reacción exotérmica, la cantidad de energía liberada durante la formación de nuevos enlaces (producto) es mayor que la cantidad total de energía necesaria mientras se rompen los enlaces (reactivos). Esta es la razón del calentamiento del sistema o las reacciones. Incluso el cambio de entalpía se vuelve más bajo al final de la reacción.
El valor de ΔH o DH o DE siempre es negativo.
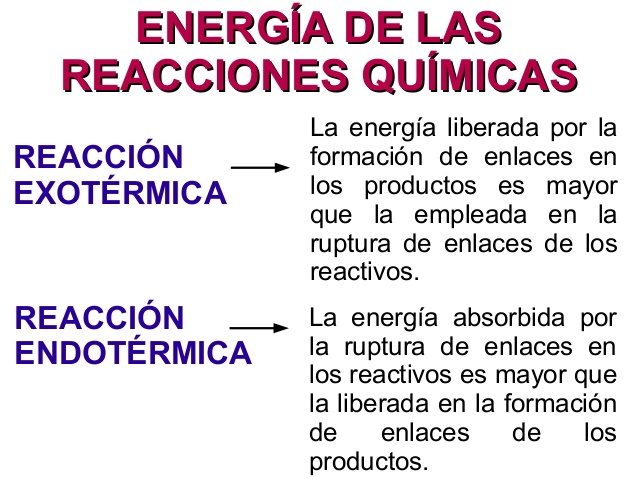
Pocos ejemplos comunes de reacciones endotérmicas son:
- 1. Combustión – Quema de carbón, una vela, azúcar.
- 2. Cuando el detergente para ropa se disuelve en agua, o cuando se agrega agua a la cal mientras se la prepara. En tal reacción, se produce una gran cantidad de calor, que calienta el agua.
- 3. Formación de hielo a partir del agua.
- 4. Respiración, digestión de los alimentos.
Conclusión
Las reacciones químicas no solo tienen lugar en los laboratorios, sino que ocurren en las rutinas diarias, también en nuestro cuerpo. Por ejemplo, la fusión de cubitos de hielo o la evaporación de agua líquida es una reacción endotérmica, por otro lado, si el agua se congela en cubitos de hielo, se denomina reacción exotérmica.
Del artículo anterior, concluimos que hay varios tipos de reacciones que tienen lugar, siempre que las moléculas interactúan entre sí. Las reacciones endotérmicas y exotérmicas son los dos tipos de reacciones químicas clasificadas por su comportamiento durante la reacción química, y encontramos estas palabras opuestas entre sí.