Los enlaces químicos son los responsables de las interacciones que atraen átomos y moléculas confiriendo estabilidad a los compuestos químicos. Hay tres tipos de enlaces químicos que pasaremos a detallar a continuación:Enlace Metálico, Enlace Iónico y Enlace Covalente.
| Tipos de Enlaces Químicos | Características | Ejemplos |
| Enlace Metálico | Se da entre átomos metálicos de un mismo elemento, transformándose en un enlace fuerte | Elementos metálicos como el hierro, sodio, plata, cobre, etc. |
| Enlace Iónico | Es la transferencia de electrones de un átomo a otro. Es la atracción electrostática entre partículas con cargas eléctricas contrarias llamado Iones | Cloruro de Sodio |
| Enlace Covalente | Se da entre átomos no metálicos y de cargas electromagnéticas semejantes que se unen. Hay variedad de las cuales están las no polar, polar, simple, doble, triple y dativo | Agua (H2O), Oxigeno Puro (O2), Hidrógeno Puro(H2), Dióxido de Carbono(CO2), etc. |
Tipos de Enlaces Químicos
Un enlace químico es la fuerza que une a los átomos para formar compuestos químicos. Esta unión le confiere estabilidad al compuesto resultante. La energía necesaria para romper un enlace químico se llama energía de enlace. Hay tres tipos de enlace entre átomos:
- Enlace Metálico: Se da únicamente entre átomos metálicos de un mismo elemento que constituyen estructuras sólidas, es un enlace fuerte, que une los núcleos atómicos entre sí rodeado de sus electrones como una nube.
- Enlace Iónico: Consiste en la unión o atracción electrostática entre partículas con cargas eléctricas de signos contrarios llamados iones.
- Enlace Covalente: no polar, polar, simple, doble, triple, dativo. Ocurre entre átomos no metálicos y de cargas electromagnéticas semejantes que se unen y comparten algunos pares de electrones de su capa de valencia.
Gracias a éstos enlaces se forman todos los compuestos que existen en la naturaleza.
Es un hecho que los átomos que forman la materia tienden a unirse a través de diversos métodos que equilibran o comparten sus cargas eléctricas naturales para alcanzar condiciones más estables que cuando están separados. Los enlaces químicos constituyen la formación de moléculas orgánicas e inorgánicas, y por tanto son parte de la base de la existencia de los organismos vivos, de manera semejante los enlaces químicos pueden romperse bajo ciertas y determinadas condiciones.
Esto puede ocurrir sometiendo los compuestos químicos a altas temperaturas, aplicando electricidad o propiciando reacciones químicas con otros compuestos, por ejemplo si aplicamos electricidad al agua es posible separar las uniones químicas entre el hidrógeno y el oxígeno que la conforman, éste proceso se denomina electrólisis.
1- Enlace Metálico
Los enlaces metálicos son, como su nombre lo indica, un tipo de unión química que se produce únicamente entre los átomos de un mismo elemento metálico, gracias a estos tipos de enlaces los metales logran estructuras moleculares muy compactas y resistentes.
Aquí lo que ocurre con los electrones de valencia es que abandonan sus órbitas alrededor del núcleo atómico cuando éste se junta con otro, y permanecen alrededor de ambos núcleos como una especie de nube electrónica. De esta manera las cargas positivas y negativas mantienen su atracción, sujetando firmemente al conjunto atómico y alcanzando márgenes importantes de dureza, compactación y durabilidad.

Propiedades de un Enlace Metálico
A los enlaces metálicos se deben muchas de las propiedades típicas de los metales, como su solidez, su dureza, e incluso su ductilidad, la buena conducción del calor y la electricidad de los metales de hecho se debe a la disposición particular de los electrones en forma de nube alrededor de los núcleos, lo que permite su movilidad a lo largo y ancho del conjunto. Es más el lustre de los metales se debe a ello, ya que ese tipo de enlace repele casi toda la energía lumínica que los impactan , es decir brillan.
Los átomos unidos mediante enlaces metálicos suelen organizarse en estructuras hexagonales, cúbicas o de forma geométrica concreta, la excepción a la regla es el mercurio, que a pesar de ser un metal , es líquido a temperatura ambiente y formas de gotas.
Ejemplos de Enlaces Metálicos
Los enlaces metálicos son la base del mundo de los metales, por lo que cualquier elemento metálico puro es perfecto ejemplo de ello, es decir cualquier elemento puro sin que se mezcle con otros metales o elementos se mantendrá unido mediante enlaces metálicos.
Ejemplos de Enlaces Metálicos:
- Enlaces entre los átomos de plata
- Enlaces entre los átomos de oro
- Enlaces entre los átomos de cadmio
- Enlaces entre los átomos de hierro
- Enlaces entre los átomos de níquel
- Enlaces entre los átomos de zinc
- Enlaces entre los átomos de cobre
2- Enlaces Iónicos
El enlace iónico, consiste en la atracción electrostática entre partículas con cargas eléctricas de signos contrarios llamados iones, el metal pierde electrones y se transforma en un ion metálico positivo llamado catión. Estos electrones pasan al elemento no metálico y se transforma en un ion cargado negativamente llamado anión.
Si bien el enlace iónico se suele distinguir del covalente, en realidad no existe un enlace iónico puro, sino que este modelo es una exageración del modelo covalente, siempre existe algún margen de covalencia en éstas uniones.
Los cationes y aniones se combinan y forman una red tridimensional que se mantienen por las fuerzas de atracción electrostática entre los iones con cargas diferentes, éstas fuerzas forman los compuestos iónicos.
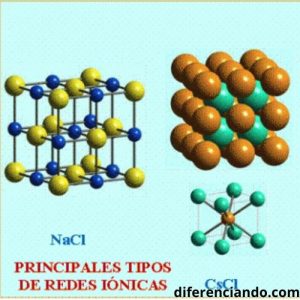
Propiedades de los compuestos Iónicos
- Son enlaces fuertes : la fuerza de esta unión atómica puede ser muy intensa.
- Suelen ser sólidos: a temperaturas normales tienen estructura molecular cúbica y rígida
- Poseen alto punto de fusión y ebullición
- Solubilidad en agua
- Conducción eléctrica
- Selectividad: los enlaces se dan sólo con algunos metales de la tabla periódica.
Ejemplos de enlaces iónicos
- Fluoruros: son empleadas en la fabricación de pastas dentales y otros insumos odontológicos
- Sulfatos: Son empleados para aditivos para materiales para la construcción.
- Nitratos: se utilizan para pólvoras, abonos y fertilizantes
- Mercurio: los compuestos de éste elemento son tóxicos para el ser humano, por lo tanto hay que manipular con precaución.
3- Enlaces Covalentes
Se llama enlace covalente a un tipo de enlace químico que ocurre cuando dos átomos se enlazan para formar una molécula, compartiendo electrones pertenecientes a su capa de valencia o último nivel de energía, alcanzando gracias a ello el «octeto estable».
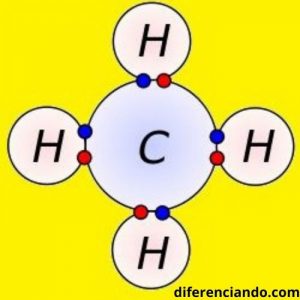
Los átomos enlazados por enlaces covalentes comparten uno o más pares de electrones de su último nivel de energía, se denomina orbital molecular a la región del espacio donde está ubicada la densidad electrónica en la molécula.
Esta densidad electrónica se puede definir y calcular utilizando ecuaciones matemáticas muy complejas que describen el comportamiento de los electrones en las moléculas, por otro lado también existen los orbitales atómicos, que se definen como a región del espacio que representa la probabilidad de encontrar un electrón alrededor del núcleo atómico. Así cuando se combinan varios orbitales atómicos, se generan orbitales moleculares.
Los enlaces covalentes se forman por comportamiento de electrones entre los átomos que se enlazan, se forma entre átomos que no tienen una gran diferencia de electronegatividad, éste enlace se puede formar entre átomos no metálicos o entre átomos metálicos y el hidrógeno.
Es importante aclarar que no existe absolutamente covalente, o un enlace absolutamente iónico, de hecho muchas veces se suele considerar al enlace iónico como una exageración del enlace covalente.
Tipos de Enlaces Covalentes
- Simple
- Doble
- Triple
- Dativo
- Enlaces Covalentes Polares
- Enlaces Covalentes no Polares
Propiedades de los enlaces covalentes
- Son solubles en agua e insolubles en disolventes como acetona, tolueno o gasolina.
- Poseen bajos puntos de fusión y ebullición.
- Son malos conductores de electricidad y calor.
Ejemplos de enlaces covalentes
- Agua (HO2)- H.O.H
- Oxígeno Puro (O2)- O=O
- Hidrógeno Puro (H2)- H-H
- Nitrógeno Puro (N2)- N=N
- Acido cianhídrico (HCN)
- Acido clorhídrico (HCl)- H-Cl
- Dióxido de Carbono ( CO2)- O=C=O