En este posteo vamos a estar hablando de un proceso sumamente interesante. Este posteo se encuentra dedicado a explicar que es la disolución, cuáles son sus características, propiedades, componentes y que tipos existen. La disolución puede parecer un proceso complejo de entender en realidad es un fenómeno que se ven en la cotidianeidad. A continuación te mostramos todo lo que necesitas saber para identificarlos fácilmente.

¿Que es una disolución?
Las disoluciones son mezclas homogéneas formadas por dos o más sustancias puras que no reaccionan químicamente entre sí. Su apariencia y su comportamiento físico es diferente cuando se combinan y cuando están separadas, pero no se alteran las propiedades químicas de cada elemento.
Es un proceso que se da a través de la mezcla de dos sustancia, el soluto y el solvente. Aquí el soluto pasa a formar parte del solvente modificando las propiedades físicas, pero no químicas.
Componentes
Los componentes contienen una división considerada por algunos arbitraria, pero a grandes rasgos pueden considerarse de la siguiente manera.
- Soluto: sustancia pura que se encuentra en menor cantidad. Puede haber más de uno.
- Solvente o disolvente: sustancia pura que está en mayor cantidad. Es uno solo.
Características
A continuación te ofrecemos una lista con algunas de las características de la disolución.
- Son mezclas completamente homogéneas a nivel físico.
- El resultado depende de la medida de concentración del soluto y del coeficiente de solubilidad en el solvente. Es decir, que tan concentrada es una sustancia pura (soluto) y que capacidad de diluirla tiene el solvente. Algunos solventes funcionan mejor con determinados solutos y viceversa.
- Las sustancias serán difícilmente separadas una vez realizada la disolución.
- Son necesarios los componentes de soluto y solvente, siendo el último mayor en cantidad.
Propiedades
Las propiedades del soluto y del solvente cambian a nivel físico, pero no químico, es decir, en apariencia son indistinguibles pero sus propiedades químicas quedan iguales. Con esto hacemos referencia a que se pueden separar las dos sustancias, aunque esto no es tan fácil, debe realizarse a través de procesos específicos, como la ebullición, la cristalización o destilación, que son métodos fraccionarios realizados en fases. Otros métodos resultan inútiles para separar estas sustancias. Algunas sustancias lograrán tal grado de homogeneización que no podrán ser separadas.
Diferencias entre solución o disolución
Estos términos son sinónimo y refieren a mezclas homogéneas por lo que se utilizan de forma indistinta. En ocasiones se suele utilizar una distinción en cuanto a la disolución hace referencia a que el solvente es líquido mientras que el soluto puede ser líquido, sólido o gaseoso, es decir, puede encontrarse en las tres formas de la materia. Mientras que la solución refieren a cuando ambas sustancias son liquidas.
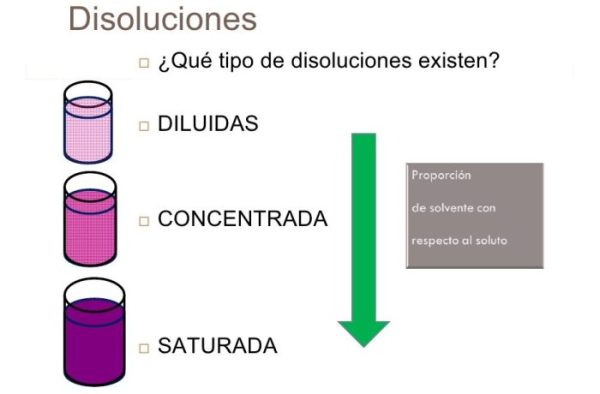
Tipos de disolución
Este tipo de clasificación se basa en la concentración final del soluto dentro del solvente.
| Disoluciones diluidas | Disoluciones concentradas | Disoluciones saturadas | Disoluciones sobresaturadas |
| Este tipo de disolución se caracteriza por tener pequeñas escalas de soluto, sean uno o más y una gran cantidad de solvente. | Este tipo de disolución consta de mayores cantidades de soluto pero el solvente sigue siendo mayor. | Este tipo de disoluciones agrega cantidades igualitarias de soluto y de solvente. Sin que se pueda agregar más soluto en esas condiciones de presión y temperatura. | Este tipo de disoluciones se caracteriza por tener más soluto del que tendría la disolución saturada a cierta temperatura y presión. Es decir se puede agregar más a través de calentar la disolución saturada y luego dejarla enfriar lentamente. Se debe manejar de forma cuidadosa, porque la mezcla se puede precipitar si se mueve de forma busca. |
Ejemplos
A continuación te presentamos diferentes ejemplos cotidianos donde dos sustancias atraviesan el proceso de disolución.
- Azúcar en agua.
- Sal en agua.
- Cafe en leche.
- Miel en leche caliente.
- Un caldo en agua.
- Nestum en agua.
- Polenta o harina de maíz en agua.
- Vinagre en agua.
- Alcohol en agua.
- Productos de limpieza líquidos en agua, tal como la lavandina.
- Agua en el aire a través de vaporización.
- Desodorantes de ambientes en el aire.
- Gas natural disuelto en aire.
- Polvo en el aire.
- Tragos donde se mezcla alcohol con jugo de frutas.
- Sangre, compuesta por múltiples componentes.
- Jugo en polvo.
- Te disuelto en agua.
- Suero, conformado por múltiples componentes nutritivos.
- Licuados.
- Perfumes.
- Acero inoxidable, conformado, por hierro, cromo y carbono.