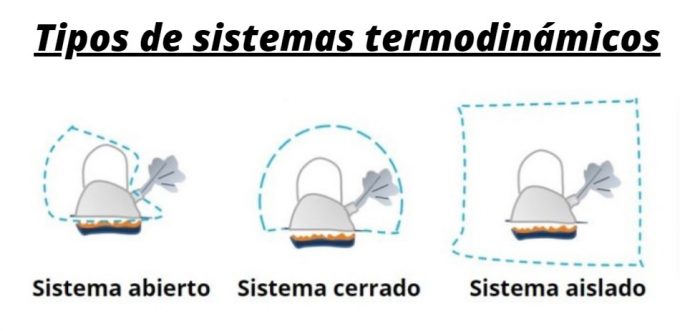
La termodinámica implica el estudio del intercambio de energía térmica entre un sistema y su entorno. Hay tres tipos de sistemas termodinámicos que varían en función de la posible transferencia de calor y materia, se clasifican en sistemas abiertos, cerrados o aislados.
Los sistemas se refieren a cualquier parte del universo que se esté estudiando. Si por ejemplo, está realizando un experimento en un vaso de precipitados, entonces el sistema que está estudiando está dentro del vaso de precipitados. El mismo estará sujeto a factores circundantes como la temperatura y la presión del aire.
Sistema abierto |
Sistema cerrado |
Sistema aislado |
|
| Masa | La masa no es fija y puede cruzar el límite del sistema | La masa es fija y no puede cruzar el límite del sistema | La masa es fija y no puede cruzar el límite del sistema |
| Energía Térmica | La energía térmica se puede intercambiar con su entorno | La energía térmica se puede intercambiar con su entorno | La energía térmica tampoco se puede intercambiar con su entorno |
| Ejemplos | Al hervir sopa en una cacerola abierta sobre una hornalla, la energía y la materia se transfieren a los alrededores a través del vapor | Cuando le ponemos una tapa a la cacerola mencionada en el ejemplo del sistema abierto. Evitamos la transferencia. | Un termo (aunque en realidad este sistema no existe porque el agua en éste no se mantiene caliente para siempre) |
Sistema termodinámicao
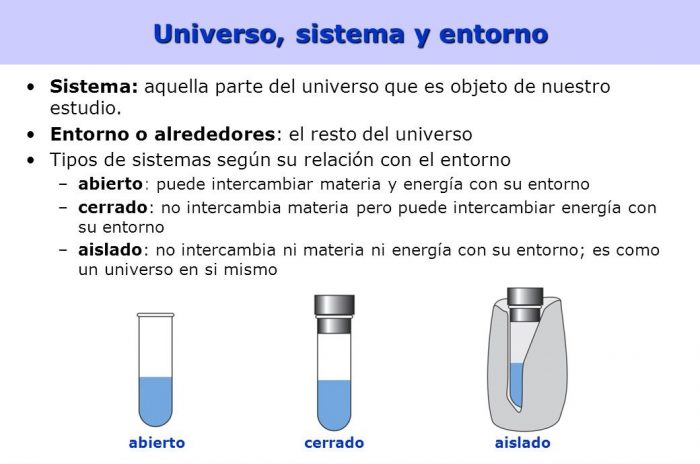
Un sistema termodinámico se define como una cantidad de materia o una región del espacio en la que se concentra la atención en el análisis de un problema.
- Todo lo externo al sistema se llama Envolvente.
- El sistema está separado del entorno por el límite del sistema. Esto puede ser fijo o móvil.
- El sistema y sus alrededores juntos componen el Universo.
- Existen tres tipos de sistema termodinámicos: Sistema cerrado, sistema abierto y sistema aislado
Sistema cerrado
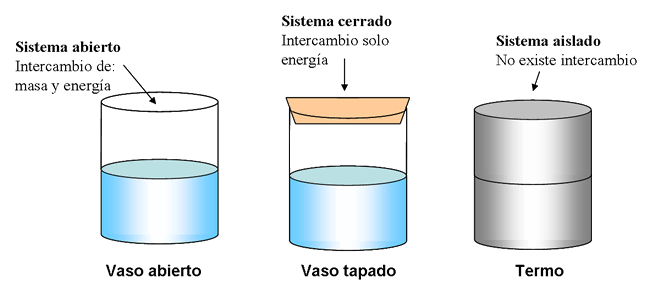
La masa es fija y no puede cruzar el límite del sistema. Esto también se denomina sistema de masa de control. La energía térmica se puede intercambiar con su entorno.
«Un sistema cerrado se define como aquel en el que la masa es fija (ninguna masa puede cruzar el límite del sistema) y la energía térmica se puede transferir a su entorno».
Ejemplo:
Cuando le ponemos la tapa a la cacerola, la convertimos en un sistema cerrado. Al hacer esto la materia ya no se puede transferir porque la tapa evita que la misma entre o salga de la cacerola. Este ejemplo lo entenderá mejor cuando terminemos de analizar el sistema abierto. Así que ahora comencemos con ello.
Sistema abierto
La masa no es fija y puede cruzar el límite del sistema. También se denomina sistema de control de volumen. La energía térmica también se puede intercambiar con su entorno.
«Un sistema abierto se define como en el que la masa y la energía térmica se pueden transferir a su entorno».
Ejemplo:
Al hervir sopa en una cacerola abierta sobre una hornalla, la energía y la materia se transfieren a los alrededores a través del vapor, este es un ejemplo de un sistema abierto. Otros ejemplos pueden ser los compresores de aire o las turbinas.
Sistema aislado
La masa es fija y jamas puede cruzar el límite del sistema. Esto también se denomina sistema de masa de control. La energía térmica tampoco se puede intercambiar con su entorno.
«Un sistema aislado se define como aquel en el que la masa es fija (ninguna masa puede cruzar el límite del sistema) y además la energía térmica no se puede transferir a su entorno».
Ejemplo:
Un termo (aunque en realidad este sistema no existe porque el agua en éste no se mantiene caliente para siempre)
Hemos llegado al final del artículo sobre las diferencias entre los sistemas abiertos, sistemas cerrados y sistemas aislados. Si se ha quedado con alguna duda, déjenos un comentario debajo, le responderemos a la brevedad.
Hasta pronto!!!