Los ácidos y bases son compuestos básicos para las reacciones químicas. Los mismos permiten regular el pH necesario para que muchas reacciones ocurran o para la conservación de distintos compuestos y microorganismos. Si eres un interesado en la química no puedes dejar de conocer cuales son las diferencias entre los ácido y las bases, que como verás más adelante, son dos caras de la misma moneda.
Ácido |
Base |
|
| Definición según Arrhenius (*) | Un ácido es cualquier compuesto químico que cuando se disuelve en agua libera H+. | Una base es cualquier compuesto químico que cuando se disuelve en agua produce OH-. |
| Definición según Bronstead- Lowry (*) | Los ácidos son sustancias capaces de ceder protones (H+) | Las bases son sustancias capaces de aceptar protones (H+) |
| Definición según Lewis (*) | Un ácido de Lewis se define como una sustancia capaz de compartir o aceptar un par de electrones. | Una base de Lewis, es una sustancia con capacidad para compartir o dar pares de electrones. |
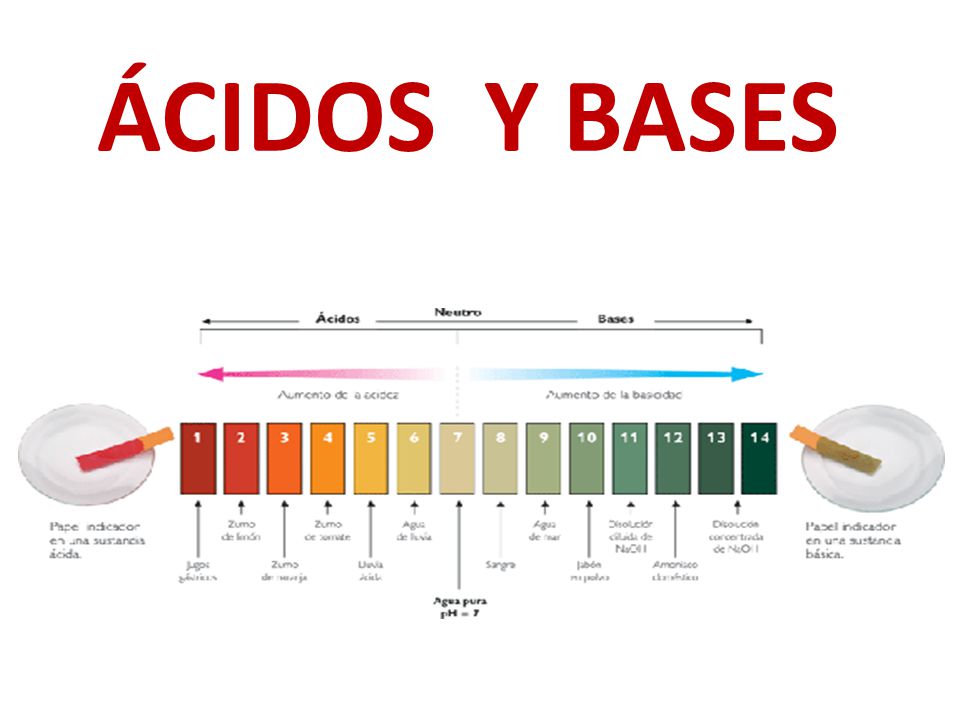
| pH | 0<pH<7 | 7<pH<14 |
| Fuertes | Se disocian completamente cuando se disuelven en agua. | Se asocian completamente a iones H+ cuando se disuelven en agua, generando iones OH-. |
| Fuertes: Ejemplos | HCl, H2SO4 | NaOH, LiOH |
| Débiles | Generan un equilibrio ácido base cuando en el agua, disociándose parcialmente según la constante de disociación ácida (Ka) de cada compuesto. | Generan un equilibrio ácido base cuando en el agua, disociándose parcialmente según la constante de disociación ácida (Ka) de cada compuesto. |
| Débiles: Ejemplos | H2CO3 | NH3, |
Qué son los ácidos
Son aquellas sustancias que son capaces de ceder protones (según Bronstead- Lowry) o de aceptar o compartir electrones (según Lewis). En agua, producen un pH menor a 7, dado que lo disminuyen desde el pH originario del agua pura: 7. Pueden clasificarse como ácidos fuertes o débiles. Los ácidos fuertes, se disocian completamente como por ejemplo HCl:
HCL —–> H+ Cl-
Los ácidos débiles se disocian parcialmente según una constante de disociación ácida (Ka) que es propia de cada ácido. Uno de ellos es, por ejemplo, el ácido carbónico que se disocia según:
H2CO3 <—> H+ + HCO3-
HCO3- <—> H+ – CO32-
Donde cada disociación tiene una Ka distinta.
Qué son las bases
Son aquellas sustancias que son capaces de aceptar protones (según Bronstead- Lowry) o de ceder o compartir electrones (según Lewis). En agua, producen un pH mayor a 7 y menor a 14, dado que lo aumentan desde el pH originario del agua pura: 7. Pueden clasificarse como bases fuertes o debiles. Las bases fuertes, se disocian completamente como por ejemplo NaOH:
NaOH —–> Na+ + OH-
Las bases débiles se disocian parcialmente según una constante de disociación ácida (Ka) que es propia de cada base. Uno de ellos es, por ejemplo, el amoniaco que acepta protones según:
NH3 + H3O+ <—> NH4+ + H2O
Ácidos y bases: Evolución de las definiciones
La definición de Arrehinius es la más antigua pues define ácidos y bases en función de su capacidad de ceder protones (H+) e iones hidróxido (OH-) respectivamente. Fue cuestionada debido a que existen sustancias que producen un aumento de la concentración de OH- sin contenerlos en su composición química. Por ejemplo, NH3:
NH3 + H20 <—> NH4+ + OH-
Una teoría más satisfactoria que la de Arrhenius es la que formularon en 1923 Brønsted y Lowry. Esta teoría diferencia los ácidos de las bases por su capacidad de ceder o aceptar protones (H+). Según esta teoría, el amoniaco (NH3) clasifica claramente como base dada su capacidad de aceptar los protones. Ellos a su vez, clasificaron los ácidos como fuertes o débiles según si aceptaban o cedían completamente sus protones (fuertes) o lo hacían de manera parcial.

Por ultimo, la teoría de Lewis va aún más allá de la variación del pH y tiene en cuenta si la sustancia acepta o cede un par de electrones electrones. Tenga en cuenta que los electrones (-) y protones (+) son partículas con carga opuestas y que son la base de todas las reacciones acido-base. El H+ se denomina protón pues es un hidrógeno que ha perdido su electrón y por ende, esta compuesto solo por su parte cargada positivamente. Por lo tanto, cuando un compuesto acepta un ión H+ está aceptando protones y cediendo electrones, funcionando de esta forma como una base de Lewis.
De este modo, todas las sustancias que para las teorías de Arrhenius o Bronsted-Lowry eran ácidos o bases, también lo son para Lewis. Sin embargo, Lewis amplia el concepto de ácido más allá de las anteriores teorías y muchos ácidos de Lewis, no lo son de Bronsted, como por ejemplo, BF3 que comparte su par libre de electrones con otros compuestos:
BF3 + :NH3 → F3B:NH3